Pada pelajaran kimia ini kita akan mempelajari tata nama senyawa kimia baiklah langsung saja tata nama senyawa kimia dibagi menjadi dua, yaitu yang pertama adalah tata nama senyawa biner (senyawa yang hanya terdiri atas dua jenis atom), dan yang kedua adalah tata nama senyawa poliatomik.
1. Tata Nama Senyawa Biner
Senyawa biner dapat terbentuk dari unsur logam dan unsur nonlogam, atau terbentuk dari unsur-unsur nonlogam.
a. Tata Nama Senyawa yang terbentuk dari Unsur Logam dan Nonlogam
1). Senyawa yang unsur logamnya memiliki satu bilangan oksidasi
(yaitu atom unsur golongan IA, IIA, dan IIIA), nama logam ditulis
terlebih dahulu diikuti dengan nama nonlogam, dan diberi akhiran -ida.
Contoh:
- NaCl = natrium klorida
- KH = Kalium Hidrida
- Na2O = natrium oksida
- Li3N = litium nitrida
- Na2S = natrium sulfida
- Mg3N2 = magnesium nitrida
- CaF2 = kalsium fluorida
- AlH3 = aluminium hidrida
- BaS = barium sulfida
- Al2S3 = aluminium sulfida
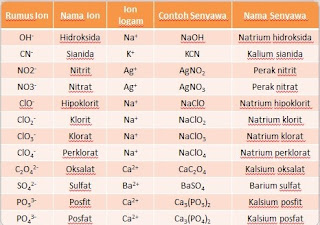
Untuk mempermudah, saya sertakan nama-nama ion positif dan ion negatif:
2). Senyawa yang unsur logamnya memiliki bilangan oksidasi lebih dari satu, muatan logamnya dituliskan menggunakan angka romawi dalam tanda kurung.
Contoh:
- FeSO4 (besi (II) sulfat), kalau diionisasi FeSO4 → Fe2+ + SO42-
- FeCl3 (besi (III) klorida), kalau diionisasi FeCl3 → Fe3+ + Cl–
b. Tata Nama Senyawa biner yang terbentuk dari unsur-unsur nonlogam
1). Nama nonlogam
yang memiliki bilangan oksidasi positif dituliskan lebih dahulu.
Bilangan oksidasinya ditulis dengan menggunakan angka romawi dalam tanda
kurung. Kemudian, diikuti dengan nama nonlogam yang memiliki biloks
negatif dengan menambahkan akhiran -ida.
Bilangan oksidasi dan tata nama senyawa biner
| Senyawa | Bilangan oksidasi positif | Nama |
| N2O | +1 | Nitrogen (I) oksida |
| NO | +2 | Nitrogen (II) oksida |
| N2O3 | +3 | Nitrogen (III) oksida |
| NO2 | +4 | Nitrogen (IV) oksida |
| N2O5 | +5 | Nitrogen (V) oksida |
| P2O3 | +3 | Fosfor (III) oksida |
| P2O5 | +5 | Fosfor (V) oksida |
| PCl5 | +5 | Fosfor (V) klorida |
| SO2 | +4 | Belerang (IV) oksida |
| SO3 | +6 | Belerang (VI) oksida |
2). Jumlah unsur
pertama dituliskan lebih dahulu, diikuti dengan nama unsur nonlogam
pertama. Kemudian menuliskan jumlah unsur kedua, diikuti dengan nama
unsur nonlogam kedua dengan diberi akhiran –ida. Awalan untuk satu
(mono) ditiadakan, kecuali untuk karbon monoksida. Jumlah unsur
dinyatakan dalam bahasa Yunani, sebagai berikut:
- 1= mono
- 2= di
- 3= tri
- 4= tetra
- 5= penta
- 6= heksa
- 7= hepta
- 8= okta
- 9= nona
- 10= deka
Rumus molekul dan tata nama beberapa senyawa
| Rumus Molekul | Nama | Rumus Molekul | Nama |
| N2O | Dinitrogen oksida | PCl5 | Fosfor pentaoksida |
| NO | Nitrogen oksida | SO2 | Belerang dioksida |
| N2O5 | Dinitrogen pentaoksida | SO3 | Belerang trioksida |
| P2O3 | Difosfor trioksida | CCl4 | Karbon tetraklorida |
| P2O5 | Difosfor pentaoksida | CO | Karbon monoksida |
Khusus untuk senyawa
biner yang terbentuk dari unsur-unsur nonlogam yang mengandung hidrogen
(H), diberikan penamaan sebagai berikut.
- HCl = asam klorida atau hidrogen klorida
- H2S = asam sulfida atau hidrogen sulfida
- H2O = air atau hidrogen oksida
- CH4 = metana (bukan karbon tetrahidrida atau hidrogen karbida)
- NH3 = amonia (bukan nitrogen trihidrida)
2. Tata Nama Senyawa Poliatom
Senyawa poliatom dibentuk oleh lebih
dari dua atom yang berbeda. Pada umumnya, anion suatu senyawa poliatom
terbentuk dari dua jenis atom yang berbeda. Nama kation disebut lebih
dulu, diikuti nama anion. Anion poliatom yang mengandung oksigen sebagai
atom pusatnya dan memiliki biloks besar, diberi –at. Adapun anion
poliatom yang memiliki bilangan oksidasi lebih kecil diberi akhiran –it.
Rumus molekul dan tata nama beberapa senyawa dan ion poliatom
| Rumus Molekul | Nama | Rumus Molekul | Nama |
| K2SO4 | Kalium sulfat | Na3PO3 | Natrium fosfit |
| K2SO3 | Kalium sulfit | PO43- | Ion fosfat |
| SO42- | Ion sulfat | PO33- | Ion fosfit |
| SO32- | Ion sulfit | KCN | Kalium sianida |
| Na3PO4 | Natrium fosfat | CN– | Ion sianida |
Itulah pelajaran kimia tentang tata nama
senyawa. apabila kalian masih bingung bisa bertanya melalui kolom komentar, saya akui pelajaran kimia ini tidaklah mudah untuk difahami, membutuhkan konsentrasi yang lebih dari biasanya.